Действующим веществом препарата является помалидомид, который относится к группе препаратов «иммунодепрессанты; другие иммунодепрессанты».
Он влияет на иммунную систему, подавляя рост и размножение опухолевых клеток миеломы (онкологическое заболевание крови).
Показания к применению
Препарат Помалидомид применяется для лечения взрослых пациентов, в возрасте старше 18 лет с онкологическим заболеванием крови, называемым «множественной миеломой».
Препарат Помалидомид применяется в комбинации с дексаметазоном (глюкокортикостероидным препаратом) у пациентов, ранее получавших терапию леналидомидом (препаратом, снижающим активность иммунитета (иммунодепрессантом)) и бортезомибом (противоопухолевым препаратом).
Если улучшение не наступило или Вы чувствуете ухудшение, необходимо обратиться к врачу.

|
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
▼ Данный лекарственный препарат подлежит дополнительному мониторингу. Это позволит быстро выявить новую информацию по безопасности. Мы обращаемся к работникам системы здравоохранения с просьбой сообщать о любых подозреваемых нежелательных реакциях. Порядок сообщения о нежелательных реакциях представлен в разделе 4.8.
1. НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Помалидомид, 1 мг, капсулы.
Помалидомид, 3 мг, капсулы.
Помалидомид, 4 мг, капсулы.
2. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
Действующее вещество: помалидомид.
Помалидомид, 1 мг, капсулы
Каждая капсула содержит 1 мг помалидомида.
Помалидомид, 3 мг, капсулы
Каждая капсула содержит 3 мг помалидомида.
Помалидомид, 4 мг, капсулы
Каждая капсула содержит 4 мг помалидомида.
Полный перечень вспомогательных веществ приведен в разделе 6.1.
3. ЛЕКАРСТВЕННАЯ ФОРМА
Капсулы.
Помалидомид, 1 мг, капсулы
Капсулы твердые желатиновые № 2 желтого цвета. Содержимое капсул – порошок от светло-желтого до желтого цвета.
Помалидомид, 3 мг, капсулы
Капсулы твердые желатиновые № 2 желтого цвета. Содержимое капсул – порошок от светло-желтого до желтого цвета.
Помалидомид, 4 мг, капсулы
Капсулы твердые желатиновые № 2 желтого цвета. Содержимое капсул – порошок от светло-желтого до желтого цвета.
4. КЛИНИЧЕСКИЕ ДАННЫЕ
4.1. Показания к применению
Помалидомид в комбинации с дексаметазоном показан к применению у взрослых для лечения рецидивирующей и рефрактерной множественной миеломы, получивших не менее двух предшествующих курсов лечения, включавших как леналидомид, так и бортезомиб, и у которых отмечалось прогрессирование заболевания на фоне последнего лечения.
4.2. Режим дозирования и способ применения
Лечение препаратом необходимо начинать и проводить только под наблюдением врача, имеющего опыт в лечении множественной миеломы.
Режим дозирования
Рекомендуемая начальная доза помалидомида составляет 4 мг внутрь 1 раз в день с 1 по 21 день повторных 28-дневных циклов.
Рекомендуемая доза дексаметазона составляет 40 мг внутрь 1 раз в день в 1, 8, 15 и 22 день каждого 28-дневного цикла.
Режим дозирования сохраняется или изменяется в зависимости от клинических и лабораторных данных. Лечение следует продолжать до прогрессирования заболевания или развития неприемлемой токсичности.
Изменение дозы помалидомида или прерывание лечения
Инструкции по прерыванию лечения или изменению дозы помалидомида в связи с нежелательными реакциями представлены в таблице ниже:
Инструкция по изменению дозы помалидомида
|
Токсичность |
Изменение дозы |
|
Нейтропения* АКН** < 0,5 х 109/л или фебрильная нейтропения (температура ≥ 38,5 °С и АКН< 1 х 109/л). |
Прервать лечение помалидомидом, не дожидаясь окончания цикла. Еженедельно выполнять ОАК***. |
|
АКН восстановилось до значений ≥1 х 109/л. |
Возобновить лечение помалидомидом в дозе 3 мг в день. |
|
Для каждого последующего снижения < 0,5 х 109/л. |
Прервать лечение помалидомидом. |
|
АКН восстановилось до значений ≥1 х 109/л. |
Возобновить лечение помалидомидом в дозе на 1 мг ниже предыдущей. |
|
Тромбоцитопения Количество тромбоцитов < 25 х 109/л. |
Прервать лечение помалидомидом, не дожидаясь окончания цикла. Еженедельно выполнять ОАК***. |
|
Количество тромбоцитов восстановилось до значений ≥50 х 109/л. |
Возобновить лечение помалидомидом в дозе 3 мг в день. |
|
Для каждого последующего снижения < 25 х 109/л. |
Прервать лечение помалидомидом. |
|
Количество тромбоцитов восстановилось до значений ≥ 50 х 109/л. |
Возобновить лечение помалидомидом в дозе на 1 мг ниже предыдущей. |
|
Сыпь Сыпь 2-3 степени тяжести. |
Рассмотреть прерывание или прекращение лечения помалидомидом. |
|
Сыпь 4 степени тяжести или буллезные нарушения (в том числе ангионевротический отек, анафилактическая реакция, эксфолиативные или буллезные высыпания или подозрение на синдром Стивенса-Джонсона (ССД), токсический эпидермальный некролиз (ТЭН) или лекарственную реакцию с эозинофилией и системными симптомами (DRESS)). |
Прекратить лечение помалидомидом (см. раздел 4.4). |
|
Прочее Другие нежелательные явления ≥3 степени тяжести, обусловленные приемом помалидомида. |
Прервать лечение помалидомидом, не дожидаясь окончания цикла. Возобновить лечение в следующем цикле в дозе на один уровень ниже предыдущей дозы (при условии разрешения или снижения тяжести нежелательного явления до ≤ 2 степени тяжести до возобновления лечения). |
*При нейтропении врач должен рассмотреть возможность применения препаратов фактора роста; **АКН — абсолютное количество нейтрофилов; ***ОАК — общий анализ крови.
Для начала нового цикла лечения помалидомидом количество нейтрофилов должно быть ≥ 1 х 109/л, а количество тромбоцитов ≥ 50 х 109/л.
При одновременном приеме сильных ингибиторов изофермента СYР1А2 (например, ципрофлоксацина эноксацина, флувоксамина) дозу помалидомида необходимо снизить на
50 %.
Инструкция по изменению дозы дексаметазона
|
Токсичность |
Изменение дозы дексаметазона |
|
Диспепсия 1-2 степени. |
Поддерживать дозу и применять блокаторы гистамина (Н2) или аналогичные средства. Снизить дозу на один уровень при сохранении симптомов. |
|
Диспепсия ≥3 степени. |
Прервать лечение до ослабления симптомов. Добавить блокаторы гистамина (Н2) или аналогичные средства и снизить дозу на один уровень при возобновлении лечения. |
|
Отек ≥ 3 степени. |
Применять диуретики по необходимости и снизить дозу на один уровень. |
|
Спутанность сознания и изменения настроения ≥ 2 степени. |
Прервать лечение до разрешения симптомов. При возобновлении лечения снизить дозу на один уровень. |
|
Мышечная слабость ≥ 2 степени. |
Прервать лечение, пока показатель мышечной слабости не станет ≤ 1 степени. При возобновлении лечения снизить дозу на один уровень. |
|
Гипергликемия ≥ 3 степени. |
Снизить дозу на один уровень. Применять инсулин или пероральные гипогликемические средства по необходимости. |
|
Острый панкреатит. |
Прекратить лечение дексаметазоном. |
|
Другие нежелательные реакции ≥ 3 степени, обусловленные дексаметазоном. |
Прервать лечение дексаметазоном, пока тяжесть нежелательной реакции не станет ≤ 2 степени. Возобновить лечение, снизив дозу на один уровень. |
Снижение дозы дексаметазона:
|
Уровень дозы |
Пациенты ≤ 75 лет (дни 1, 8, 15 и 22 повторных 28-дневных циклов) |
Пациенты >75 лет (дни 1, 8, 15 и 22 повторных 28-дневных циклов) |
|
Начальная доза |
40 мг |
20 мг |
|
Уровень дозы -1 |
20 мг |
12 мг |
|
Уровень дозы -2 |
10 мг |
8 мг |
Лечение дексаметазоном следует отменить при непереносимости дозы 10 мг (пациенты ≤ 75 лет) или 8 мг (пациенты > 75 лет).
Если токсические явления сохраняются более 14 дней, дозу дексаметазона следует снизить на один уровень.
Пропуск дозы
Если пациент забыл принять помалидомид в какой-либо день, то на следующий день он должен принять обычную дозу в соответствии с назначением. Пациент не должен изменять дозу препарата для восполнения пропущенной накануне дозы.
Пациенты пожилого возраста
Изменение дозы помалидомида не требуется. Для пациентов в возрасте > 75 лет начальная доза дексаметазона составляет 20 мг 1 раз в день в 1, 8, 15 и 22 день каждого 28-дневного цикла лечения.
Пациенты с нарушением функции печени
Пациентов, у которых значения общего сывороточного билирубина превышали > 1,5 х ВГН (верхняя граница нормы), не включали в клинические исследования. Нарушение функций печени не оказывает существенного влияния на фармакокинетику помалидомида (см. раздел 5.1). Не требуется изменения начальной дозы помалидомида у пациентов с печеночной недостаточностью, определенной по Чайлд-Пью. Тем не менее, пациентов с нарушением функций печени необходимо тщательно наблюдать для своевременного выявления нежелательных реакций. При необходимости следует уменьшить дозу или прервать прием помалидомида.
Пациенты с нарушением функции почек
Не требуется изменения дозы помалидомида у пациентов с почечной недостаточностью. В дни гемодиализа помалидомид следует принимать после выполнения процедуры.
Дети
Безопасность и эффективность препарата Помалидомид у детей в возрасте от 0 до 18 лет на данный момент не установлены. Имеющиеся на сегодняшний день данные приведены в разделах 4.8, 5.1, 5.2, однако невозможно дать рекомендации по режиму дозирования.
Способ применения
Для приема внутрь.
Твердые капсулы препарата Помалидомид следует принимать внутрь каждый день в одно и то же время. Капсулы нельзя открывать, разламывать или разжевывать. Капсулы препарата Помалидомид следует проглатывать целиком, запивая водой, вне зависимости от приема пищи.
Меры предосторожности, принимаемые перед применением препарата или работе с ним
Информация по работе с цитотоксическими препаратами приведена в разделе 6.6.
4.3. Противопоказания
- Гиперчувствительность к помалидомиду или любому из вспомогательных веществ, перечисленных в разделе 6.1.
- Беременность (см. раздел 4.6.).
- Для женщин: сохраненный детородный потенциал, за исключением случаев, когда соблюдены все необходимые условия Программы предохранения от беременности (см. разделы 4.4 и 4.6).
- Для мужчин: невозможность или неспособность соблюдать необходимые меры контрацепции (см. раздел 4.4).
4.4. Особые указания и меры предосторожности при применении
Лечение препаратом Помалидомид необходимо начинать и проводить под наблюдением опытного гематолога или химиотерапевта.
Программа предохранения от беременности
Неукоснительное соблюдение всех требований Программы предохранения от беременности должно распространяться на всех пациентов, если достоверно не доказано отсутствие у них детородного потенциала.
Для женщин без детородного потенциала
Женщина-пациент или женщина, сексуальный партнер мужчины-пациента, НЕ считаются способными к деторождению при наличии хотя бы одного из перечисленных факторов:
- возраст ≥ 50 лет и длительность естественной аменореи ≥ 1 года (аменорея вследствие противоопухолевой терапии или в период грудного вскармливания не исключает наличие детородного потенциала);
- ранняя недостаточность яичников, подтвержденная врачом-гинекологом;
- двусторонняя сальпингоофорэктомия или гистерэктомия в анамнезе;
- генотип ХY, синдром Тернера, анатомический дефект матки.
Консультирование
Применение помалидомида у женщин с сохраненным детородным потенциалом противопоказано в случае, если неверно одно из следующих утверждений:
Женщина должна
- понимать возможность тератогенного действия помалидомида на плод;
- понимать необходимость постоянного использования эффективных методов контрацепции в течение как минимум 4 недель до начала лечения, во время лечения и как минимум 4 недель после окончания лечения помалидомидом;
- даже в случае аменореи соблюдать все правила эффективной контрацепции;
- быть способной к соблюдению всех правил эффективной контрацепции;
- знать и понимать возможные последствия в случае наступления беременности на фоне приема помалидомида, а также необходимость срочного обращения за консультацией при подозрении на наступившую беременность;
- понимать необходимость неотложного начала приема помалидомида после получения отрицательных результатов теста на беременность;
- осознавать необходимость проведения теста на беременность и выполнять его каждые 4 недели за исключением женщин с подтвержденной хирургической стерилизацией;
- подтвердить, что понимает риск и необходимые меры предосторожности, связанные с приемом помалидомида.
Врач должен убедиться, что женщина с сохраненным детородным потенциалом:
- соответствует всем условиям Программы предупреждения беременности, включая адекватный уровень понимания ее требований;
- согласна с вышеперечисленными условиями.
Применение у мужчин
Данные изучения фармакокинетики помалидомида у мужчин-добровольцев свидетельствуют о том, что помалидомид может содержаться в семенной жидкости пациента во время лечения. В качестве меры предосторожности и принимая во внимание особые группы пациентов с потенциально увеличенным временем выведения, например, с печеночной недостаточностью, все мужчины, принимающие помалидомид, должны соблюдать следующие условия:
Мужчина должен
- понимать возможный риск тератогенного действия помалидомида при сексуальном контакте с беременной женщиной или женщиной с сохраненным детородным потенциалом;
- понимать необходимость использования презервативов при сексуальном контакте с беременной женщиной или женщиной с сохраненным детородным потенциалом, не использующей надежные методы контрацепции, в период лечения, перерыва в лечении и в течение 7 дней после приостановки и/или завершения лечения. Эта рекомендация относится и к мужчинам после вазэктомии, которые также должны использовать презерватив при сексуальном контакте с беременной женщиной или женщиной с сохраненным детородным потенциалом, поскольку и в отсутствии сперматозоидов его семенная жидкость может содержать помалидомид;
- понимать, что если его партнерша забеременела во время его лечения помалидомидом или в течение 7 дней после прекращения терапии помалидомидом, он должен сразу же проинформировать об этом своего лечащего врача, а его партнерше рекомендуется обратиться к врачу-тератологу для обследования и консультации.
Женщины с сохраненным детородным потенциалом должны использовать один из высокоэффективных методов контрацепции в течение как минимум 4 недель до начала лечения, во время лечения и в течение как минимум 4 недель после окончания лечения помалидомидом даже в случае перерыва в лечении. Исключение составляют пациентки, которые на протяжении длительного времени полностью воздерживаются от сексуальных отношений, что подтверждается ежемесячно. Если пациентке не подобран эффективный метод контрацепции, ее необходимо направить к гинекологу для подбора метода контрацепции и начала его применения.
К примерам высокоэффективных методов контрацепции относят:
- подкожные гормональные импланты;
- внутриматочные системы, выделяющие левоноргестрел;
- депо-препараты медроксипрогестерон ацетата;
- перевязку маточных труб;
- сексуальные отношения с партнером, перенесшим вазэктомию; вазэктомия подтверждается двумя отрицательными анализами семенной жидкости;
- прогестерон-содержащие таблетки, ингибирующие овуляцию (например, дезогестрел).
Прием комбинированных пероральных контрацептивов не рекомендован больным множественной миеломой в связи с повышенным риском тромбоэмболических осложнений на фоне лечения помалидомидом и дексаметазоном (см. раздел 4.5). Если пациентка использует комбинированные пероральные контрацептивы, ее следует перевести на один из эффективных методов контрацепции, перечисленных выше. Повышенный риск развития тромбоэмболии сохраняется в течение 4-6 недель после прекращения приема комбинированных противозачаточных средств. Эффективность гормональных противозачаточных препаратов может быть снижена при одновременном назначении дексаметазона (см. раздел 4.5).
Подкожные гормональные импланты или внутриматочные системы, выделяющие левоноргестрел, связаны с повышенным риском инфекционных осложнений в момент их установки и с нерегулярными влагалищными кровотечениями. Пациенткам с нейтропенией, использующим эти способы контрацепции, следует профилактически назначать антибиотики.
Использование внутриматочных систем, выделяющих медь, как правило, не рекомендуется в связи с высоким риском развития инфекционных осложнений в момент имплантации и повышенной кровопотери во время менструации, которая может усилить выраженность нейтропении или тромбоцитопении.
В соответствии с принятой практикой, тесты на беременность с минимальной чувствительностью 25 мМЕ/мл должны проводиться под контролем врача всеми женщинами с сохраненным детородным потенциалом, включая тех, которые полностью и длительно воздерживаются от сексуальных отношений.
Согласно рекомендациям, проведение теста на беременность, назначение и выдача препарата должны проводиться в один и тот же день. Женщина с сохраненным детородным потенциалом должна получить помалидомид не позднее 7 дней после назначения лечения.
До начала лечения
После того как пациентка использовала эффективный метод контрацепции в течение 4 или более недель, тест выполняется под контролем лечащего врача в день назначения помалидомида или за 3 дня до визита к лечащему врачу. Тест должен подтвердить отсутствие у пациентки беременности на момент начала приема помалидомида.
Во время и после лечения
Тест на беременность под наблюдением врача следует повторять как минимум каждые 4 недели, включая как минимум 4 недели после окончания лечения, за исключением женщин с подтвержденной хирургической стерилизацией. Тесты выполняются в день визита или в течение 3 дней перед визитом к лечащему врачу.
Пациенты не должны передавать препарат другим лицам. По окончании лечения неиспользованный препарат рекомендуется возвратить в медицинское учреждение.
Пациентам не разрешается быть донорами крови, семени или спермы на протяжении всего времени лечения (включая перерывы в лечении) и в течение 7 дней после завершения приема помалидомида.
Обучающие материалы, ограничения в назначении и выдаче препарата
Чтобы помочь пациентам избежать воздействия помалидомида на плод, владелец регистрационного удостоверения предоставит медицинскому персоналу обучающие материалы по мерам предосторожности в отношении вероятной тератогенности помалидомида, способам контрацепции перед началом терапии и руководство по проведению необходимых тестов на беременность. Врач должен информировать пациента о возможном тератогенном риске помалидомида и строгих мерах по предупреждению беременности в соответствии с Программой предохранения от беременности, и обеспечить пациента обучающей брошюрой, карточкой пациента и/или эквивалентным инструментом в соответствии с национальной системой карточек пациентов. Контролируемая система распределения включает использование карточек пациентов и/или эквивалентного инструмента для контроля назначений и/или выдачи препарата. Проведение теста на беременность, назначение и выдачу препарата рекомендуется проводить в один день. Выдача помалидомида женщинам с сохраненным детородным потенциалом должна происходить не позже 7 дней после назначения терапии и получения отрицательного результата теста на беременность, выполненного под наблюдением врача.
Выдача препарата женщинам с сохраненным детородным потенциалом должна производиться не более чем на 4 недели лечения в соответствии с показаниями и схемами применения (см. раздел 4.2), всем остальным категориям пациентов — не более чем на 12 недель.
Гематологические осложнения
У пациентов с рецидивирующей/резистентной множественной миеломой в группе нежелательных явлений 3 или 4 степени тяжести наиболее часто регистрируется нейтропения; следующие по частоте анемия и тромбоцитопения. У пациентов необходимо мониторировать нежелательные гематологические реакции, особенно нейтропению. Пациенты должны быть проинформированы о необходимости своевременно сообщать о повышении температуры. Врачи должны наблюдать за пациентами в отношении симптомов повышенной кровоточивости, включая носовые кровотечения, особенно при сопутствующей терапии препаратами, повышающими риск кровотечений (см. раздел 4.8). Полный анализ крови необходимо выполнить до начала лечения, затем еженедельно - в течение первых 8 недель, далее - раз в месяц. Может потребоваться изменение дозы помалидомида (см. раздел 4.2), применение кровезаменителей и/или препаратов фактора роста.
Тромбоэмболические осложнения
У пациентов при лечении помалидомидом в комбинации с дексаметазоном развивались венозные тромбоэмболические нарушения (в основном тромбоз глубоких вен и тромбоэмболия легочной артерии - ТЭЛА) и артериальные тромботические нарушения (инфаркт миокарда и инсульт). Пациенты с наличием факторов риска тромбоэмболии, включая предшествующие тромбозы, должны находиться под тщательным наблюдением. Необходимо предпринять все возможные меры для минимизации факторов риска (например, курение, гипертензия, гиперлипидемия). Пациенты и врачи должны следить за признаками и симптомами тромбоэмболий. Пациентов необходимо предупредить, что им следует обратиться за медицинской помощью при появлении таких симптомов, как одышка, боли в груди, отеки рук и ног. При отсутствии противопоказаний рекомендуется лечение антикоагулянтами (такими как ацетилсалициловая кислота, варфарин, гепарин или клопидогрел), особенно у пациентов с дополнительными факторами риска тромбоза.
Решение о проведении профилактических мероприятий принимается после тщательной оценки факторов риска у каждого пациента. В клинических исследованиях пациенты профилактически получали ацетилсалициловую кислоту или другую противотромботическую терапию. Применение эритропоэтических средств сопровождается риском тромботических осложнений, включая тромбоэмболии. Следовательно, эритропоэтические препараты, а также другие средства, которые могут повышать риск тромбоэмболий, должны применяться с осторожностью.
Заболевания щитовидной железы
Сообщалось о случаях гипотиреоза. Перед началом лечения необходимо проводить контроль сопутствующих заболеваний, способных влиять на функцию щитовидной железы. Рекомендуется проводить оценку функции щитовидной железы перед началом лечения и регулярный контроль функции щитовидной железы во время лечения.
Периферическая нейропатия
Пациентов с периферической нейропатией ≥ 2 степени тяжести не включали в клинические исследования помалидомида. При решении вопроса о назначении лечения помалидомидом таким пациентам нужно проявлять осторожность.
Выраженное нарушение функции сердца
Пациентов с выраженными нарушениями функции сердца (застойная сердечная недостаточность [Класс III или IV по NYHA]; инфаркт миокарда в течение 12 месяцев до начала исследования; нестабильная или плохо контролируемая стенокардия) не включали в клинические исследования помалидомида. Осложнения в виде сердечной недостаточности, включая застойную сердечную недостаточность и отек легких (см. раздел 4.8) отмечали, в основном, у пациентов с уже существующей сердечной недостаточностью или факторами риска заболеваний сердца. При решении вопроса о назначении лечения помалидомидом таким пациентам нужно проявлять осторожность, включая регулярные осмотры для выявления симптомов сердечной недостаточности.
Синдром лизиса опухоли
Наибольший риск синдрома лизиса опухоли имеется у пациентов с большой опухолевой нагрузкой на момент начала лечения. За этими пациентами должно быть организовано тщательное наблюдение с применением соответствующих профилактических мер.
Первичные опухоли другой локализации
Образование первичных злокачественных опухолей другой локализации, таких как немеланоцитарный рак кожи, зарегистрировано у пациентов, получавших помалидомид (см. раздел 4.8). Врач должен тщательно обследовать пациентов до и во время лечения с помощью стандартных методов скрининга новообразований для выявления первичной опухоли другой локализации, и, при необходимости, назначить соответствующее лечение.
Аллергические реакции и тяжелые кожные реакции
На фоне применения помалидомида были зарегистрированы ангионевротический отек, анафилактическая реакция и тяжелые кожные реакции, включая ССД, ТЭН и DRESS (см. раздел 4.8). Пациенты должны быть проинформированы о признаках и симптомах этих реакций и предупреждены о необходимости немедленно обратиться за медицинской помощью при появлении подобных симптомов. Лечение помалидомидом следует прекратить при развитии эксфолиативной или буллезной сыпи или при подозрении на ССД, ТЭН и DRESS. Лечение не должно возобновляться после разрешения вышеуказанных реакций. Пациентов с серьезными аллергическими реакциями на талидомид или леналидомид в анамнезе не включали в клинические исследования помалидомида. Такие пациенты могут иметь повышенный риск развития реакций гиперчувствительности и не должны получать помалидомид. Следует рассмотреть возможность прерывания или прекращения лечения помалидомидом в случае кожной сыпи 2 – 3 степени тяжести. При развитии ангионевротического отека и анафилактической реакции помалидомид должен быть отменен.
Головокружение и спутанность сознания
Имеются сообщения о возникновении головокружений и спутанности сознания на фоне помалидомида. Пациентам следует избегать ситуаций, когда головокружение и спутанность сознания могут представлять проблему, и не принимать другие лекарственные средства, которые могут вызывать такие же нарушения, без предварительной медицинской консультации.
Интерстициальное заболевание легких (ИЗЛ)
ИЗЛ и другие сходные явления, включая случаи пневмонита, наблюдались на фоне лечения помалидомидом. Пациентам с острыми симптомами или необъяснимым ухудшением легочной симптоматики следует провести тщательное обследование для исключения ИЗЛ. В ходе этого обследования лечение помалидомидом должно быть приостановлено, а при подтверждении диагноза ИЗЛ назначена соответствующая терапия. Лечение помалидомидом может быть возобновлено только после тщательной оценки пользы и риска.
Заболевания печени
Выраженное повышение активности аланинаминотрансферазы и концентрации билирубина отмечали у пациентов, принимавших помалидомид (см. раздел 4.8). Зарегистрированы также случаи гепатита, которые привели к прекращению лечения помалидомидом. Регулярный контроль функции печени рекомендуется в течение первых 6 месяцев терапии помалидомидом, а в последующем по клиническим показаниям.
Инфекции
Сообщалось о редких случаях реактивации вируса гепатита В (НВ) у пациентов, ранее инфицированных вирусом гепатита В, при лечении помалидомидом в комбинации с дексаметазоном. В нескольких случаях отмечалось прогрессирование гепатита до острой печеночной недостаточности, в результате чего помалидомид был отменен. До начала лечения помалидомидом необходимо выполнить тест на наличие и активность вируса гепатита В. Для пациентов с положительным тестом на наличие вируса гепатита В рекомендуется консультация врача, имеющего опыт лечения пациентов с вирусным гепатитом В. Следует соблюдать осторожность при сочетанном применении помалидомида и дексаметазона у пациентов, перенесших вирусный гепатит В, включая пациентов с положительным тестом на анти-НВс антиген, но отрицательным тестом на HBs антиген. За такими пациентами необходимо установить тщательное наблюдение в течение всего курса терапии для своевременного выявления симптомов и признаков активного заболевания, вызванного вирусом гепатита В.
Прогрессирующая мультифокальная лейкоэнцефалопатия
Сообщалось о случаях развития прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) у пациентов, принимавших помалидомид, включая случаи с летальным исходом. Согласно сообщениям ПМЛ развивалась в период от нескольких месяцев до нескольких лет после начала лечения помалидомидом. В основном сообщалось о случаях ПМЛ у пациентов, получавших сопутствующее лечение дексаметазоном, или ранее прошедших химиотерапию другим иммунодепрессивным препаратом. Врачам следует регулярно проводить медицинский осмотр пациентов. При составлении дифференциального диагноза у пациентов с новыми или прогрессирующими неврологическими симптомами, признаками когнитивных и поведенческих нарушений, необходимо учитывать возможность развития ПМЛ. Пациентов следует предупредить о том, что им стоит сообщить своим близким и лицам, ухаживающими за ними, о лечении, поскольку они могут заметить симптомы, о которых пациент не знает.
Диагностика ПМЛ должна включать неврологическое обследование, проведение магнитно- резонансной томографии головного мозга и анализа спинномозговой жидкости на наличие ДНК вируса Джона Каннингема (вируса JC) методом полимеразной цепной реакции (ПЦР). В качестве альтернативы ПЦР-исследованию может быть проведена биопсия головного мозга для определения вируса JC. Отрицательный результат ПЦР-исследования на вирус JC не исключает развитие ПМЛ. Необходимо обеспечить дополнительное наблюдение за пациентом и провести дополнительные исследования, если альтернативный диагноз не может быть установлен.
При наличии подозрения на развитие ПМЛ следует приостановить прием до ее исключения. В случае подтверждения ПМЛ, следует окончательно прекратить лечение помалидомидом.
4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Влияние помалидомида на другие лекарственные препараты
Считается, что помалидомид не вызывает клинически значимых фармакокинетических лекарственных взаимодействий, связанных с угнетением или индукцией изоферментов цитохрома Р450, или активацией или угнетением транспортных систем, при совместном применении с субстратами этих ферментов или транспортерами. Возможность таких лекарственных взаимодействий, включая влияние помалидомида на фармакокинетику комбинированных пероральных контрацептивов, клинически не оценивалась (см. раздел 4.4).
Влияние других лекарственных препаратов на помалидомид
Помалидомид частично метаболизируется изоферментами СYP1А2 и СYР3А4/5 и является субстратом для Р-гликопротеина. Комбинированное применение помалидомида с сильным ингибитором изофермента СYР3А4/5 и P-gp кетоконазолом или с сильным индуктором изофермента СYР3А4/5 карбамазепином клинически значимо не влияло на действие помалидомида. Совместное применение сильного ингибитора изофермента СYР1А2 флувоксамина в присутствии кетоконазола увеличивало воздействие помалидомида в среднем на 107 % при 90 % ДИ [91 % – 124 %] в сравнении с комбинацией помалидомид-кетоконазол. В другом иследовании влияния ингибитора изофермента СYР1А2 на изменения метаболизма, при сочетанном применении ингибитора изофермента СYР1А2 флувоксамина и помалидомида, средняя экспозиция помалидомида увеличилась на 125 % [90 % ДИ 98 % –
157 %] в сравнении с применением помалидомида в монотерапии. Если сильный ингибитор изофермента СYР1А2 (например, ципрофлоксацин, эноксацин и флувоксамин) применяют совместно с помалидомидом, необходимо уменьшить дозу помалидомида на 50 %.
Комбинированная терапия помалидомидом в повторных дозах до 4 мг и дексаметазоном в дозах 20 – 40 мг (слабый-умеренный индуктор некоторых ферментов СYР, включая изофермент СYР3А) у пациентов с множественной миеломой не сопровождалась нарушением фармакокинетики помалидомида по сравнению с монотерапией помалидомидом.
Влияние дексаметазона на варфарин не изучено, поэтому рекомендуется тщательно мониторировать концентрацию варфарина на фоне комбинированной терапии.
4.6. Фертильность, беременность и лактация
Женщины с детородным потенциалом (контрацепция у мужчин и женщин)
Женщины с сохраненным детородным потенциалом должны использовать эффективный метод контрацепции. Если беременность наступила во время лечения помалидомидом, то прием препарата должен быть прекращен, а женщина должна быть направлена к врачу-тератологу для обследования и консультации. Если беременность наступила у женщины, партнер которой получает помалидомид, она должна быть направлена к врачу-тератологу для обследования и консультации. Помалидомид обнаруживается в семенной жидкости человека. В качестве меры предосторожности все пациенты мужского пола должны использовать презервативы в течение всего курса лечения, в перерывах между лечением и в течение 7 дней после прекращения лечения, если их партнерша беременна или имеет сохраненный детородный потенциал и не использует какой-либо метод контрацепции (см. разделы 4.3 и 4.4).
Беременность
Помалидомид может обладать тератогенным действием у людей.
Препарат противопоказан во время беременности и у женщин с сохраненным детородным потенциалом, за исключением случаев применения с соблюдением всех условий предохранения от беременности (см. разделы 4.3 и 4.4).
Лактация
Не установлено, выделяется ли помалидомид с грудным молоком человека. Помалидомид обнаруживался в молоке крыс, которым вводили препарат. Учитывая возможность нежелательного действия помалидомида на новорожденных необходимо прекратить либо грудное вскармливание, либо прием препарата, принимая во внимание важность грудного вскармливания и лечения для матери.
Фертильность
У животных помалидомид обладает неблагоприятным влиянием на фертильность и тератогенным эффектом. Помалидомид проникает через плаценту и обнаруживается в крови плода (согласно данным, полученным на кроликах) (см. раздел 5.3).
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Помалидомид обладает незначительным или умеренным влиянием на способность управлять транспортными средствами или механизмами. Некоторые побочные действия препарата Помалидомид, такие как утомляемость, заторможенность, спутанность сознания и головокружение, могут отрицательно влиять на способность управления автомобилем и выполнение потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций. При появлении таких нежелательных явлений следует воздержаться от выполнения данных видов деятельности.
4.8. Нежелательные реакции
Резюме профиля безопасности
Во время клинических исследований наиболее частыми нежелательными реакциями были нарушения со стороны крови и лимфатической системы: анемия (45,7 %), нейтропения
(45,3 %) и тромбоцитопения (27 %); среди общих нарушений и реакций в месте введения преобладали утомляемость (28,3 %), повышение температуры (21 %) и периферические отеки (13 %); среди инфекций и паразитарных заболеваний - пневмония (10,7 %). Как побочное действие периферическая нейропатия зарегистрирована у 12,3 % пациентов, а венозные эмболические и тромботические нарушения (ВЭТН) - у 3,3 % пациентов. Наиболее частыми нежелательными реакциями 3 или 4 степени были нарушения со стороны крови и лимфатической системы, включая нейтропению (41,7 %), анемию (27 %) и тромбоцитопению (20,7 %); среди инфекций и инвазий - пневмония (9 %); среди общих расстройств и нарушений в месте введения препарата - утомляемость (4,7 %), повышение температуры (3%) и периферические отеки (1,3 %). Наиболее частой серьезной нежелательной реакцией оказалась пневмония (9,3 %). Из других серьезных нежелательных реакций зарегистрированы фебрильная нейтропения (4,0 %), нейтропения (2,0 %), тромбоцитопения (1,7 %) и ВЭТН
(1,7 %). Нежелательные реакции чаще возникали во время первых двух циклов лечения помалидомидом.
Табличное резюме нежелательных реакций
В рандомизированном исследовании СС-4047-ММ-003 302 пациента с рецидивирующей и рефрактерной множественной миеломой получали помалидомид по 4 мг 1 раз в день с 1 по 21 день повторных 28-дневных циклов в комбинации с еженедельной низкой дозой дексаметазона.
Нежелательные реакции (НЛР), возникавшие у пациентов при лечении комбинацией помалидомида и дексаметазона, представлены ниже в таблице 1 в соответствии с классификацией поражений органов и систем органов MedDRA с учетом частоты всех НЛР и частоты НЛР 3 или 4 степени тяжести.
Приведена частота развития нежелательных реакций в группе лечения помалидомидом в комбинации с дексаметазоном в исследовании СС-4047-ММ-003 (n = 302). Нежелательные реакции перечислены ниже в соответствии с классификацией по основным системам и органам и частоте встречаемости, которая была определена в соответствии с классификацией Всемироной организации здравоохранения (ВОЗ): очень часто
(≥ 1/10); часто (≥ 1/100, < 1/10); нечасто (≥ 1/1000 и < 1/100); редко (≥ 1/10000 и < 1/1000); очень редко (< 1/10000); частота неизвестна (не может быть установлена на основании имеющихся данных).
Таблица 1. НЛР, зарегистрованные в клиническом исследовании ММ-003 у пациентов на фоне терапии помалидомидом и дексаметазоном
|
Системно-органный класс |
Нежелательные реакции (суммарно), частота |
Нежелательные реакции 3-4 степени тяжести, частота |
|
Инфекции и инвазии |
Очень часто: пневмония (бактериальная, вирусная и грибковая инфекция, включая оппортунистические инфекции). Часто: нейтропенический сепсис, бронхопневмония, бронхит, инфекции дыхательных путей, инфекции верхних дыхательных путей, назофарингит, опоясывающий лишай. |
Часто: нейтропенический сепсис, пневмония (бактериальная, вирусная и грибковая инфекция, включая оппортунистические инфекции), бронхопневмония, инфекции дыхательных путей, инфекции верхних дыхательных путей. Нечасто: бронхит, опоясывающий лишай. |
|
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы) |
Нечасто: базально-клеточная карцинома кожи, плоскоклеточная карцинома кожи. |
Нечасто: базально-клеточная карцинома кожи, плоскоклеточная карцинома кожи. |
|
Нарушения стороны крови и лимфатической системы |
Очень часто: нейтропения, тромбоцитопения, лейкопения, анемия. Часто: фебрильная нейтропения. |
Очень часто: нейтропения, тромбоцитопения, анемия. Часто: фебрильная нейтропения, лейкопения. |
|
Нарушения метаболизма и питания |
Очень часто: снижение аппетита. Часто: гиперкалиемия, гипонатриемия. |
Часто: гиперкалиемия, гипонатриемия. Нечасто: снижение аппетита. |
|
Психические нарушения |
Часто: спутанность сознания. |
Часто: спутанность сознания. |
|
Нарушения со стороны нервной системы |
Часто: заторможенность, периферическая сенсорная нейропатия, головокружение, тремор. |
Часто: заторможенность. Нечасто: периферическая сенсорная нейропатия, головокружение, тремор. |
|
Нарушения со стороны органа слуха и лабиринта |
Часто: вертиго. |
Часто: вертиго. |
|
Нарушения со стороны сосудов |
Часто: тромбоз глубоких вен. |
Нечасто: тромбоз глубоких вен. |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Очень часто: одышка, кашель. Часто: тромбоэмболия легочной артерии. |
Часто: одышка. Нечасто: тромбоэмболия легочной артерии, кашель. |
|
Желудочно-кишечные нарушения |
Очень часто: диарея, тошнота, запор. Часто: рвота, желудочно-кишечное кровотечение. |
Часто: диарея, рвота, запор . Нечасто: тошнота, желудочно-кишечное кровотечение. |
|
Нарушения со стороны печени и желчевыводящих путей |
Нечасто: гипербилирубинемия. |
Нечасто: гипербилирубинемия. |
|
Нарушения со стороны кожи и подкожных тканей |
Часто: сыпь, кожный зуд. |
Часто: сыпь. |
|
Нарушения со стороны мышечной, скелетной и соединительной ткани |
Очень часто: боль в костях, мышечные спазмы. |
Часто: боль в костях. Нечасто: мышечные спазмы. |
|
Нарушения со стороны почек и мочевыводящих путей |
Часто: почечная недостаточность, задержка мочи. |
Часто: почечная недостаточность. Нечасто: задержка мочи. |
|
Нарушения со стороны репродуктивной системы и молочных желез |
Часто: боли в области малого таза. |
Часто: боли в области малого таза. |
|
Общие нарушения и реакции в месте введения |
Очень часто: утомляемость, повышение температуры, периферические отеки |
Часто: утомляемость, повышение температуры, периферические отеки. |
|
Лабораторные и инструментальные данные |
Часто: нейтропения, лейкопения, тромбоцитопения, повышение активности аланинаминотрансферазы. |
Часто: нейтропения, лейкопения, тромбоцитопения, повышение активности аланинаминотрансферазы. |
В дополнение к вышеописанным нежелательным реакциям, выявленным в основных клинических испытаниях, в таблице ниже представлены данные по нежелательным реакциям, выявленным в течение пострегистрационного наблюдения.
|
Системно-органный класс |
Нежелательные реакции (суммарно), частота |
Нежелательные реакции 3-4 степени тяжести, частота |
|
Инфекции и инвазии |
Частота неизвестна: реактивация вируса гепатита В. |
Частота неизвестна: реактивация вируса гепатита В. |
|
Нарушения со стороны крови и лимфатической системы |
Часто: панцитопения. |
Часто: панцитопения. |
|
Нарушения со стороны иммунной системы |
Часто: ангионевротический отек, крапивница. Частота неизвестна: анафилактическая реакция. |
Нечасто: ангионевротический отек, крапивница. Частота неизвестна: анафилактическая реакция. |
|
Эндокринные нарушения |
Нечасто: гипотиреоз. |
|
|
Нарушения метаболизма и питания |
Часто: гиперурикемия. Нечасто: синдром лизиса опухоли. |
Часто: гиперурикемия Нечасто: синдром лизиса опухоли |
|
Нарушения со стороны нервной системы |
Часто: внутричерепное кровотечение. Нечасто: инсульт. |
Нечасто: инсульт, внутричерепное кровотечение. |
|
Нарушения со стороны сердца
|
Часто: сердечная недостаточность, фибрилляция предсердий, инфаркт миокарда. |
Часто: сердечная недостаточность, фибрилляция предсердий. Нечасто: инфаркт миокарда. |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Часто: носовое кровотечение, интерстициальное заболевание легких. |
Нечасто: носовое кровотечение, интерстициальное заболевание легких. |
|
Нарушения со стороны печени и желчевыводящих путей |
Нечасто: гепатит. |
|
|
Нарушения со стороны кожи и подкожных тканей
|
Частота неизвестна: лекарственная реакция с эозинофилией и системными симптомами, токсический эпидермальный некролиз, синдром Стивенса-Джонсона. |
Частота неизвестна: лекарственная реакция с эозинофилией и системными симптомами, токсический эпидермальный некролиз, синдром Стивенса-Джонсона. |
|
Лабораторные и инструментальные данные |
Часто: повышение концентрации мочевой кислоты в плазме крови. |
Нечасто: повышение концентрации мочевой кислоты в плазме крови. |
Описание отдельных нежелательных реакций
Помалидомид структурно сходен с талидомидом, известным тератогеном для человека, который вызывает тяжелые, угрожающие жизни врожденные дефекты. Обнаружено тератогенное действие помалидомида в период основного органогенеза при его применении у крыс и кроликов (см. разделы 4.6 и 5.3). При применении помалидомида во время беременности у людей вероятно проявление его тератогенного действия (см. раздел 4.4).
Нейтропения и тромбоцитопения
Нейтропения была зарегистрирована у 45,3 % пациентов, получающих помалидомид в сочетании с дексаметазоном в низкой дозе (Роm + LD-Dex). Нейтропения 3 или 4 степени тяжести возникала у 41,7 % пациентов, при этом нейтропения редко была серьезной (2,0 % пациентов), не приводила к прекращению лечения, была причиной перерыва в лечении у 21 % пациентов и причиной снижения дозы у 7,7 % пациентов.
Фебрильная нейтропения (ФН) была отмечена у 6,7 % пациентов на фоне Роm + LD-Dex. Все проявления были 3 и 4 степени тяжести. ФН признана серьезной у 4,0 % пациентов, была причиной перерыва в лечении у 3,7 % пациентов, причиной снижения дозы - у 1,3 % пациентов. Ни у одного пациента лечение полностью не прекращалось.
Тромбоцитопения была зарегистрирована у 27,0 % пациентов, получавших Роm + LD-Dex. Тромбоцитопения 3 или 4 степени тяжести была у 20,7 % пациентов, при этом тромбоцитопения расценена как серьезная у 1,7 % пациентов, стала причиной снижения дозы у 6,3 %, перерыва в лечении у 8 % и прекращения лечения у 0,7 % пациентов.
Инфекции
Инфекции оказались наиболее частым негематологическим проявлением токсичности: они зарегистрированы у 55,0 % пациентов при лечении Роm + LD-Dex. Примерно половина этих инфекций была 3 или 4 степени тяжести. Наиболее частыми осложнениями были пневмония и инфекции верхних дыхательных путей (у 10,7 % и 9,3 % пациентов, соответственно). В 24,3 % случаев инфекции были серьезными и у 2,7 % пациентов оказались летальными (5 степень тяжести). Инфекции потребовали прекращения лечения у 2,0 % пациентов, прерывания лечения у 14,3 % и снижения дозы у 1,3 % пациентов.
Тромбоэмболические нарушения
Венозные эмболические или тромботические нарушения (ВЭТН) выявлены у 3,3 % пациентов, получавших Роm + LD-Dex. Эти нарушения 3 или 4 степени тяжести отмечены у 1,3 % пациентов. У 1,7 % пациентов ВЭТН признаны серьезными. ВЭТН не сопровождались летальным исходом и не требовали прекращения лечения.
Профилактическое применение ацетилсалициловой кислоты (или других антикоагулянтов у пациентов с высоким риском) было обязательным. При отсутствии противопоказаний рекомендовалось также лечение антикоагулянтами.
Периферическая нейропатия
Периферическая нейропатия, в основном 1 или 2 степени тяжести, отмечалась у 12,3 % пациентов при лечении Роm+ LD-Dex. Реакции 3 или 4 степени тяжести зарегистрированы у 1,0 % пациентов. Серьезных периферических нейропатий не развивалось, а лечение в этой связи было прекращено у 0,3 % пациентов.
Медиана времени до манифестации периферической нейропатии составляла 2,1 недели при колебаниях от 0,1 до 48,3 недель.
Медиана времени до разрешения этого осложнения составляла 22,4 недели.
Кровотечения
Сообщалось о случаях кровотечений на фоне лечения помалидомидом, особенно у пациентов с наличием факторов риска, таких как сопутствующий прием препаратов, увеличивающих риск кровотечений. Эпизоды кровотечений включали в себя носовые, внутричерепные и желудочно-кишечные кровотечения.
Аллергические реакции и тяжелые кожные реакции
Ангионевротический отек, анафилактическая реакция и тяжелые кожные реакции, включая ССД, ТЭН и DRESS синдромы были зарегистрированы на фоне применения помалидомида. Пациенты с тяжелой кожной реакцией в анамнезе, связанной с лечением леналидомидом или талидомидом, не должны получать помалидомид (см. раздел 4.4).
Дети
НЛР, зарегистрированные у детей и подростков (в возрасте от 4 до 18 лет) с рецидивирующими или прогрессирующими опухолями головного мозга, соответствовали известному профилю безопасности помалидомида у взрослых пациентов (см. раздел 5.1).
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
Российская Федерация
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Адрес: 109012, г. Москва, Славянская площадь, д. 4, стр. 1
Тел.: +7 (499) 578-06-70, +7 (499) 578-02-20, +7 800 550 99 03
Факс: +7 (495) 698-15-73
Электронная почта: pharm@roszdravnadzor.gov.ru
Сайт в информационно-телекоммуникационной сети «Интернет»: www.roszdravnadzor.gov.ru
4.9. Передозировка
Симптомы
Помалидомид в высоких однократных дозах до 50 мг у здоровых добровольцев и в дозах 10 мг при повторных ежедневных приемах у пациентов с множественной миеломой не вызывал серьезных нежелательных реакций, обусловленных передозировкой.
Лечение
В исследованиях было отмечено, что помалидомид удаляется при гемодиализе.
В случае передозировки рекомендуется поддерживающая терапия.
5. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: иммунодепрессанты; другие иммунодепрессанты.
Код АТХ: L04AX06.
Механизм действия, фармакодинамические эффекты
Помалидомид обладает прямой антимиеломной тумороцидной активностью, демонстрирует иммуномодулирующее действие и угнетает стромальные клетки, поддерживающие рост опухолевых клеток миеломы. Помалидомид избирательно угнетает пролиферацию и вызывает апоптоз гематопоэтических клеток опухоли. Кроме того, помалидомид угнетает пролиферацию линий клеток множественной миеломы, устойчивых к леналидомиду, и обладает синергизмом с дексаметазоном по способности вызывать апоптоз как чувствительных, так и устойчивых к леналидомиду линий опухолевых клеток. Помалидомид усиливает клеточный иммунитет с участием Т-клеток и природных киллеров и угнетает образование провоспалительных цитокинов (например, фактора некроза опухоли-α, TNF-α, и интерлейкина-6, IL-6) моноцитами. Помалидомид также тормозит ангиогенез, блокируя миграцию и адгезию клеток эндотелия.
Помалидомид связывается непосредственно с белком цереблоном, входящим в состав комплекса Е3 убиквитинлигазы, который включает белок-1 (DDBl), связывающийся с поврежденной дезоксирибонуклеиновой кислотой (ДНК), куллин 4 (CUL4) и регулятор куллинов (Rocl), и подавляет самоубиквитинирование цереблона внутри этого комплекса. Разнообразие влияний помалидомида на клетки можно отчасти объяснить действием Е3-убиквитинлигаз, опосредующих полиубиквитинирование различных субстратных белков.
В присутствии помалидомида в условиях in vitro субстратные белки Aiolos и Ikaros подвергаются убиквитинированию и последующему разложению, что приводит к прямым цитотоксическим и иммуномодулирующим эффектам. В условиях in vivo помалидомид снижает уровень белка Ikaros у пациентов с рецидивирующей множественной миеломой, рефрактерной к леналидомиду.
Дети
В рамках простого открытого исследования фазы 1 с увеличением дозы, проведенном в одной группе пациентов, максимальная переносимая доза и/или рекомендуемая доза фазы 2 помалидомида у детей и подростков была определена на уровне 2,6 мг/м2/день при пероральном применении с 1 по 21 день повторного 28-дневного цикла.
Эффективность не была продемонстрирована в многоцентровом открытом исследовании фазы 2, проведенном в параллельных группах с участием 52 детей и подростков, получавших помалидомид, в возрасте от 4 до 18 лет с рецидивирующей или прогрессирующей глиомой высокой степени злокачественности, медуллобластомой, эпендимомой или диффузной глиомой ствола головного мозга (ДГСГМ) с преимущественным расположением в центральной нервной системе.
В исследовании фазы 2 у двух пациентов в группе глиомы высокой степени злокачественности (N = 19) был достигнут ответ, определенный протоколом; один из этих пациентов достиг частичного ответа, а другой пациент достиг долгосрочной стабилизации заболевания, что привело к объективному ответу и долгосрочной стабилизации заболевания на уровне 10,5% (95% ДИ: 1,3, 33,1). Один пациент в группе эпендимомы (N = 9) достиг долгосрочной стабилизации заболевания, в результате которой объективный ответ и долгосрочная стабилизации заболевания составили 11,1% (95% ДИ: 0,3, 48,2). Ни у одного из оцениваемых пациентов ни в группе ДГСГМ (N = 9), ни в группе медуллобластомы (N = 9) не наблюдалось подтвержденного объективного ответа или долгосрочной стабилизации заболевания. Ни одна из 4 параллельных групп, оцениваемых в этом исследовании фазы 2, не достигла первичной конечной точки объективного ответа или долгосрочной стабилизации заболевания.
Общий профиль безопасности помалидомида у детей и подростков соответствовал известному профилю безопасности препарата у взрослых пациентов. Фармакокинетические параметры оценивались в интегрированном фармакокинетическом анализе исследований фазы 1 и фазы 2, в рамках которых было выявлено отсутствие значительных отличий от параметров, которые наблюдались у взрослых пациентов (см. раздел 5.2).
5.2. Фармакокинетические свойства
Абсорбция
После однократного приема внутрь величина всасывания помалидомида составляет не менее 73 % и его максимальная концентрация в плазме крови (Сmах) достигается через 2 – 3 часа. Системное воздействие помалидомида (по показателю AUC, площадь под кривой «концентрация-время») возрастает почти линейно и пропорционально дозе. При многократном дозировании степень накопления помалидомида составляет 27-31 % по AUC.
При совместном приеме с высококалорийной пищей со значительным содержанием жиров скорость всасывания помалидомида замедляется, среднее значение Сmах снижается примерно на 27 %, но общее всасывание практически не изменяется, средняя величина AUC уменьшается на 8 %. Поэтому помалидомид можно принимать вне зависимости от приема пищи.
Распределение
Средний кажущийся объем распределения (Vd/F) помалидомида при равновесной концентрации находится в пределах 62-138 л. После применения помалидомида в течение 4 дней по 2 мг в день он обнаруживается в семенной жидкости здоровых добровольцев в концентрации примерно 67 % от уровня в плазме крови, который достигается через 4 часа (примерное Тmах) после приема препарата. In vitro связывание энантиомеров помалидомида с белками плазмы крови человека находится в пределах от 12 % до 44 % и не зависит от концентрации.
Биотрансформация
У здоровых добровольцев после однократного приема внутрь [14С]-помалидомида (2 мг) основным компонентом в крови был помалидомид (примерно 70 % от уровня радиоактивности плазмы). Количество метаболитов не превышало 10 % относительно исходного соединения или общего уровня радиоактивности плазмы.
Гидроксилирование с последующей глюкуронизацией или гидролизом является основным метаболическим путем для экскретируемой радиоактивности. In vitro изоферменты системы цитохрома Р450, СYР1А2 и СYР3А4 оказались главными ферментами, участвующими в гидроксилировании помалидомида. Меньшее значение имели изоферменты СYР2С19 и CYP2D6. Помалидомид является также субстратом Р-гликопротеина (P-gp) in vitro. Комбинированное применение помалидомида с сильным ингибитором изофермента СYР3А4/5 и P-gp кетоконазолом или с сильным индуктором изофермента СYР3А4/5 карбамазепином не оказывало клинически значимого эффекта на экспозицию помалидомида. Совместное применение сильного ингибитора изофермента СYР1А2 флувоксамина в присутствии кетоконазола увеличивало среднюю экспозицию помалидомида на 107 % при 90 % доверительном интервале [91 % - 124 % ] в сравнении с комбинацией помалидомид-кетоконазол. В другом иследовании влияния ингибитора изофермента СYР1А2 на изменения метаболизма при сочетанном применении ингибитора изофермента СYР1А2 флувоксамина и помалидомида средняя экспозиция помалидомида увеличилась на 125 % при 90 % доверительном интервале (ДИ) [98 % - 157 %] в сравнении с применением помалидомида в монотерапии. Если совместно с помалидомидом применяется сильный ингибитор изофермента СYР1А2 (например, ципрофлоксацин, эноксацин и флувоксамин), дозу помалидомида необходимо уменьшить на 50 %. Применение помалидомида у курильщиков, употребляющих табак со свойствами индуктора изофермента СYР1А2, не оказывало клинически значимого эффекта на экспозицию помалидомида по сравнению некурящими пациентами.
На основании данных in vitro помалидомид не индуцирует и не угнетает изоферменты системы цитохрома Р450, не ингибирует другие изученные транспортеры лекарственных веществ. При комбинировании помалидомида с субстратами таких путей клинически значимые лекарственные взаимодействия маловероятны.
Элиминация
Средний период полувыведения помалидомида из плазмы крови составляет 9,5 часов у здоровых добровольцев и 7,5 часов у пациентов с множественной миеломой. Средний общий клиренс (CL/F) препарата составляет приблизительно 7 – 10 л/ч.
У здоровых добровольцев после однократного приема внутрь [14С]-помалидомида (2 мг) примерно 73 % и 15 % радиоактивной дозы выводилось через почки и кишечник. При этом около 2 % и 8 % дозы помалидомида с углеродной меткой выводилось через почки и кишечник в неизмененном виде.
Помалидомид в значительной степени подвергается биотрансформации, и образующиеся метаболиты выводятся, преимущественно, через почки. Три основных метаболита, образовавшиеся в результате гидролиза или гидроксилирования с последующей глюкуронизацией, составляют, соответственно, 23 %, 17 % и 12 % от общего содержания метаболитов в моче.
Количество метаболитов, образовавшихся с участием цитохрома Р450, составило примерно
43 % от уровня общей радиоактивности, а не-СYР зависимых гидролитических метаболитов - 25 %. В неизмененном виде выводится 10 % помалидомида (2 % - через почки и 8 % - через кишечник).
Нарушение функции почек
Анализ данных популяционной фармакокинетики показал, что фармакокинетические параметры помалидомида существенно не меняются у пациентов с почечной недостаточностью (определенной по клиренсу креатинина (КК) или расчетной скорости клубочковой фильтрации, рСКФ) в сравнении с пациентами с сохраненной функцией почек (КК ≥ 60 мл/мин).
Средняя нормализованная экспозиция помалидомида (определенная по AUC) у пациентов с почечной недостаточностью средней степени тяжести (рСКФ от ≥ 30 до ≤ 45 мл/мин/1,73 м2) составила 98,2 % [90 % ДИ 77,4 % – 120,6 %] от аналогичного показателя у пациентов с нормальной функцией почек. Средняя нормализованная экспозиция помалидомида (определенная по AUC) у пациентов с почечной недостаточностью тяжелой степени тяжести (КК < 30 или рСКФ < 30 мл/мин/1,73 м2) составила 100,2 % [90 % ДИ 79,7 % – 127,0 %] от аналогичного показателя у пациентов с нормальной функцией почек. Средняя нормализованная экспозиция помалидомида (определенная по AUC) у пациентов с почечной недостаточностью тяжелой степени тяжести, нуждающихся в гемодиализе (КК < 30 мл/мин), увеличилась на 35,8 % [90 % ДИ 7,5 % – 70,0%] в сравнении с аналогичным показателем у пациентов с нормальной функцией почек. Средние изменения экспозиции помалидомида в каждой группе пациентов с нарушением функции почек не достигли величины, требующей изменения дозы.
Нарушение функции печени
Изменения параметров фармакокинетики у пациентов с печеночной недостаточностью (определенной по Чайлд-Пью) в сравнении со здоровыми добровольцами были умеренными. У пациентов с печеночной недостаточностью легкой степени тяжести средняя экспозиция помалидомида увеличивалась на 51 % [90 % ДИ 9 % – 110 %] в сравнении со здоровыми добровольцами. У пациентов с печеночной недостаточностью средней степени тяжести средняя экспозиция помалидомида увеличилась в среднем на 58 % [90 % ДИ 13 % – 119 %] в сравнении со здоровыми добровольцами, тогда как у пациентов с тяжелой печеночной недостаточностью - на 72 % [90 % ДИ 24 % – 138 %]. Среднее повышение экспозиции помалидомида у пациентов с печеночной недостаточностью в каждой группе не достигало величины, требующей изменения его дозы (см. раздел 4.2).
Лица пожилого возраста
Анализ данных популяционной фармакокинетики у здоровых добровольцев и пациентов с множественной миеломой не выявил значимого влияния возраста (19-83 года) на клиренс помалидомида при пероральном приеме. В клинических исследованиях не требовалось изменения дозы у пациентов в возрасте > 65 лет, получавших помалидомид (см. раздел 4.2).
Другие особые группы или состояния
Анализ данных популяционной ФК с использованием двухкамерной модели показал, что здоровые субъекты и пациенты с множественной миеломой имели сравнимые кажущийся клиренс (CL/F) и кажущийся объем распределения в центральной камере (V2/F). В периферических тканях помалидомид поглощался преимущественно опухолями с кажущимся периферическим клиренсом распределения (Q/F) и кажущимся периферическим объемом распределения (V3/F), соответственно, в 3,7 и 8 раз выше, чем у здоровых субъектов.
Дети
После однократного перорального приема помалидомида детьми и подростками с рецидивирующей или прогрессирующей первичной опухолью головного мозга среднее значение Tmах составляло от 2 до 4 часов после введения дозы и соответствовало среднему геометрическому значению Сmах (CV%) 74,8 (59,4%), 79,2 (51,7%) и 104 (18,3%) нг/мл при уровнях доз 1,9, 2,6 и 3,4 мг/м2, соответственно. AUC0-24 и AUC0-inf характеризовались аналогичным тенденциям, общий уровень воздействия находился в диапазоне приблизительно от 700 до 800 ч•нг/мл при двух более низких дозах и приблизительно 1200 ч•нг/мл при высокой дозе. Расчетный период полувыведения находился в диапазоне приблизительно от 5 до 7 часов.
Четких тенденций, связанных со стратификацией по возрасту и употреблением стероидов в максимально допустимой дозе, не было.
В целом согласно данным AUC увеличивалась почти пропорционально увеличению дозы помалидомида, в то время как увеличение Сmах было, как правило, менее чем пропорциональным.
Фармакокинетика помалидомида после перорального приема в дозах от 1,9 мг/м2/день до
3,4 мг/м2/день была определена у 70 пациентов в возрасте от 4 до 20 лет в интегрированном анализе исследований фазы 1 и фазы 2 при рецидивирующих или прогрессирующих опухолях головного мозга у детей. Данные зависимости «концентрация - время» применительно к концентрации помалидомида в сыворотке крови описали надлежащим образом на основе однокамерной модели с всасыванием и выведением первого порядка. Помалидомид продемонстрировал линейную и независящую от времени фармакокинетики, которая характеризуется умеренной вариабельностью. Типичные значения CL/F, Vc/F, Ка, латентного периода помалидомида составляли 3,94 л/ч, 43,0 л, 1,45 ч -1 и 0,454 ч, соответственно. Конечный период полувыведения помалидомида составил 7,33 часа. За исключением площади поверхности тела, ни одна из тестируемых ковариант, включая возраст и пол, не влияла на фармакокинетику помалидомида. Хотя площадь поверхности тела была определена как статистически значимая ковариата помалидомида CL/F и Vc/F, влияние площади поверхности тела на параметры воздействия не считалось клинически значимым.
В целом, существенной разницы между фармакокинетикой помалидомида у детей и взрослых пациентов нет.
5.3. Данные доклинической безопасности
Помалидомид не проявлял мутагенного действия и не вызывал хромосомных аберраций в лимфоцитах периферической крови человека или образования микроядер в полихроматических эритроцитах костного мозга крыс в дозах до 2000 мг/кг/день.
Помалидомид обладал тератогенным эффектом как у крыс, так и у кроликов при применении в период основного органогенеза.
6. ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
6.1. Перечень вспомогательных веществ
Кальция гидрофосфат (кальция гидрофосфат безводный)
Натрия крахмалгликолят (тип А)
Кремния диоксид коллоидный
Натрия стеарилфумарат
Капсулы твердые желатиновые № 2
Состав капсулы (корпус и крышечка): титана диоксид (Е171) – 1,0000%, оксид железа желтый (Е172) – 1,0000%, желатин – до 100%.
6.2. Несовместимость
Не применимо.
6.3. Срок годности (срок хранения)
2 года.
6.4. Особые меры предосторожности при хранении
Хранить при температуре не выше 25 ºС.
6.5. Характер и содержание первичной упаковки
По 7 капсул в упаковку ячейковую контурную из материала композитного ПА/Ал/ПВХ-пленки и фольги алюминиевой печатной лакированной.
По 3 упаковки ячейковые контурные вместе с листком-вкладышем помещают в пачку картонную.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения препарата и другие манипуляции с препаратом
Меры предосторожности при утилизации и обращении
Для того, чтобы извлечь капсулу из блистера, следует нажать только на один конец капсулы, выдавливая его через фольгу. Не нужно нажимать в центр капсулы, так как это может привести к ее повреждению.
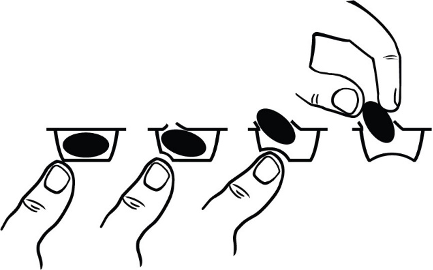
Капсулы нельзя раскрывать или разламывать. При попадании порошка помалидомида на кожу, ее необходимо немедленно промыть водой с мылом. При контакте помалидомида со слизистыми оболочками, их следует тщательно промыть водой.
Медицинским работникам и лицам, осуществляющим уход за пациентом, необходимо надевать одноразовые перчатки при осуществлении манипуляций с блистером или капсулами. После завершения манипуляций необходимо аккуратно снять перчатки таким образом, чтобы предотвратить воздействие помалидомида на кожу, поместить их в плотно закрывающийся полиэтиленовый пакет и утилизировать в соответствии с установленными национальным законодательством и требованиями. Затем необходимо тщательно вымыть руки водой с мылом. Женщины с подтвержденной или предполагаемой беременностью не должны брать блистер или капсулы в руки.
Неиспользованный лекарственный препарат и загрязненные им материалы должны быть утилизированы в соответствии с установленными национальным законодательством требованиями. По окончании лечения неиспользованный препарат рекомендуется возвратить в медицинское учреждение.
7. ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
Российская Федерация
Открытое акционерное общество "Фармстандарт-Уфимский витаминный завод"
(ОАО "Фармстандарт-УфаВИТА")
Адрес: 450077, Республика Башкортостан, г. Уфа, ул. Худайбердина, д. 28
Тел./факс: (347) 272-92-85
Адрес электронной почты: info@pharmstd.ru
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
Российская Федерация
Открытое акционерное общество "Фармстандарт-Уфимский витаминный завод"
(ОАО "Фармстандарт-УфаВИТА")
Адрес: 450077, Республика Башкортостан, г. Уфа, ул. Худайбердина, д. 28
Тел./факс: (347) 272-92-85
Адрес электронной почты: info@pharmstd.ru
8. НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
9. ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
Дата первой регистрации:
10. ДАТА ПЕРЕСМОТРА ТЕКСТА
Общая характеристика лекарственного препарата Помалидомид доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет» http://eec.eaeunion.org

Телефон: +7 (495) 970 0030
Факс: +7 (495) 970 0032
Московская область,
г. Долгопрудный Лихачевский проезд, дом 5Б
© 2007–